WA CLINICは、厚生労働所の認可を取得し、再生医療を提供する医療機関です。
2014年11月、「再生医療等の安全性の確保等に関する法律」が施行されました。この法律は、再生医療を提供しようとする医療機関などを全て認可制にすることにより、再生医療を受ける方の安全性を確保するものです。
WA CLINICは、治療の妥当性や安全性などを適切と認められ、4つの治療において厚生労働省へ「再生医療提供計画書」を提出し、再生医療第二種・第三種の認可を取得しています。
厚生労働省の認可を受けた治療
- 真皮線維芽細胞療法
- 脂肪幹細胞療法 注入
- 脂肪幹細胞療法 点滴
- PRP(多血小板血漿)療法
安全な治療の実施
WA CLINICでは、個別の治療ごとに定められたガイドラインや自主基準を厳守した治療を行います。
「一般社団法人日本再生医療学会」より出された『間葉系幹細胞等の経静脈内投与の安全な実施への提言』(令和5年7月14日)に準じた治療体制の整備。
- 塞栓症のリスクのある方への投与は実施しません。
- インフォームドコンセントを行ったうえで、治療を行います。
- 提言に準じた物品を使用し、投与速度を定め、1回当たりの細胞投与数は2億個以下とします。
- 容態急変に備えた救急用品、機器、薬剤等の準備を行い、緊急時の搬送先として三井記念病院との連携を確認しています。
幹細胞培養上清液(エクソソーム)を用いた治療を行う際に、その品質やリスクの管理について、「一般社団法人日本再生医療学会」の『細胞外小胞等の臨床応用に関するガイダンス(第1版)』に則った、安全な実施に努めています。
”エクソソーム”を取り巻く課題
”エクソソーム”を謳った製品や治療に関して、現時点では再生医療に関連する法規制の対象とはなっておらず、世界的に劣悪な製品が流通していることや、安易な投与が行われていることへの問題提起がなされています。
実際に、市場に流通している幹細胞培養上清液の中には、効果的な精製が行われず、アンモニアなどの不純物が約80%も占めている製品もみられる現状もあります。
日本においては、再生医療等提供機関へ向けて厚生労働省から、幹細胞培養上清液及びエクソソーム等を用いる治療を行う際には、その品質やリスクの管理等について、安全な実施に努めるよう求められており、一般社団法人日本再生医療学会より「細胞外小胞等の臨床応用に関するガイダンス(第1版)」を参照することを推奨されています。
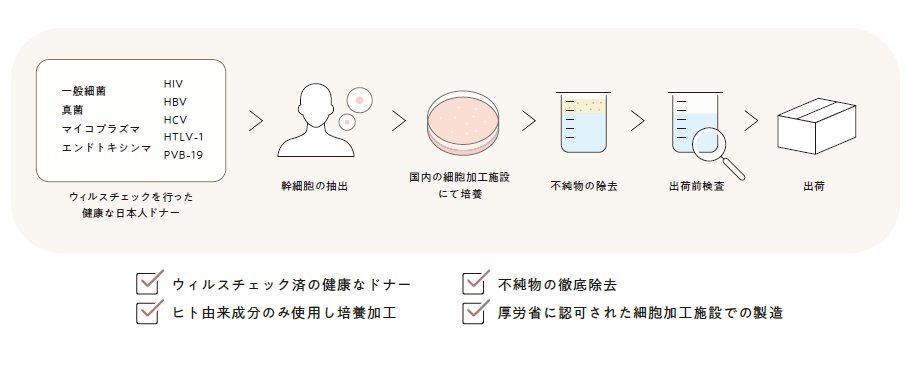
WA CLINICで扱う幹細胞培養上清液(エクソソーム)は、正常な日本人をドナーとして抽出された「ヒト幹細胞培養上清液」を使用します。
ウィルスチェックを行った健康なドナーから抽出した幹細胞・血清を使用し、培養加工する段階においても、アレルギーや炎症を惹起する可能性のある、ウシやヒツジなど成分は一切使用せず、ヒト由来成分のみを使用しています。
また、製造から出荷までを、大学の研究所内にある細胞加工施設で一元管理し、伝染性のあるウィルスや細菌はもちろん、DNA断片などの不純物をすべて除去し、さらに、出荷前の製品についても有害物質およびウィルスの有無をチェックすることで安全性を確保しています。